Arzneimittel sind ohne Zweifel wichtige und wirksame Instrumente in der medizinischen Versorgung. Sie heilen oder lindern Krankheiten oder sorgen dafür, dass Beschwerden erst gar nicht auftreten. Zugleich bieten sie bei richtiger Anwendung die Möglichkeit einer wirtschaftlichen Therapie. Doch bevor es zur Anwendung neuer Medikamente kommt, ist – richtigerweise – ein Zulassungs- sowie seit 2011 ein Nutzenbewertungsverfahren zu durchlaufen.
Alle wirksamen Arzneimittel haben auch unerwünschte Wirkungen (Nebenwirkungen). Daher ist es eine wichtige Anforderung aus Gründen des Patientenschutzes, dass Arzneimittel eine Zulassungsprozedur durchlaufen, in der die Wirksamkeit, Unbedenklichkeit und Produktqualität geprüft werden. Der jeweilige pharmazeutische Unternehmer führt dazu klinische Prüfungen durch, nachdem Tierversuche gezeigt haben, dass mit der Anwendung des neuen Wirkstoffes keine auffälligen und problematischen Begleiterscheinungen verbunden sind.
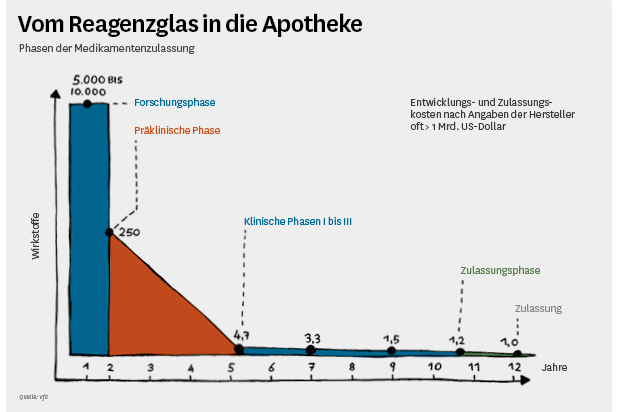
Geregelt wird der Zulassungsprozess in Deutschland durch das Arzneimittelgesetz (AMG), in dem auch die drei Phasen bei der Prüfung am Menschen vorgeschrieben werden, die ein Arzneimittel vor der Zulassung durchlaufen muss. Nach einer entsprechenden Prüfung durch eine Ethikkommission und eine Aufklärung durch die verantwortlichen Ärzte bekommen zunächst gesunde Probanden in der Phase I das neue Arzneimittel, um die Verträglichkeit und die Verstoffwechselung des Mittels in einem menschlichen Körper zu untersuchen. Danach folgen die Phasen II und III, in denen Patienten, die unter der Krankheit leiden und mit dem neuen Mittel behandelt werden sollen, das neue Arzneimittel bekommen.
Dabei werden die Dosierung, Wirksamkeit und Verträglichkeit geprüft und das Ergebnis der Wirksamkeit sowie die Häufigkeit der auftretenden unerwünschten Wirkungen gegenüber einem Vergleichs- oder Scheinmedikament festgestellt. Diese Prüfungen sind typischerweise von vielen Ein- und Ausschlusskriterien begleitet (beispielsweise nur Patienten bestimmten Alters, zumeist mehr Männer als Frauen, relativ begrenzte Dauer und begrenzte Anzahl von Patienten).
Wenn alle Prüfungen abgeschlossen sind und die Wirksamkeit der Arzneimittel im vom Hersteller ausgewählten Indikationsgebiet bei gleichzeitiger Unbedenklichkeit (Verträglichkeit) gezeigt haben, kann der pharmazeutische Unternehmer die gesammelten Unterlagen aus allen durchgeführten Untersuchungen und Prüfungen der Zulassungsbehörde einreichen. Dort werden diese Unterlagen daraufhin geprüft, ob sie vollständig und aussagekräftig genug sind, um dem Zulassungsantrag des pharmazeutischen Herstellers stattgeben zu können, und die Zulassung nicht wegen einer negativen Risiko-Nutzen-Relation versagen zu müssen. Die Zulassung ist daher vor allem von der Prüfung eines möglichen Schadens bestimmt; eine Folge des Contergan-Skandals Anfang der 1960er Jahre, der zu verschärften Anforderungen im AMG geführt hat.
Für eine Zulassung zum deutschen Markt ist das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) zuständig. Wenn ein Hersteller das Mittel aber in allen europäischen Ländern anbieten möchte, kann er auch das zentrale Zulassungsverfahren bei der Europäischen Arzneimittelagentur (EMA) nutzen, das in ganz ähnlichen regulatorischen Schritten vor sich geht und vergleichbare An-forderungen hat. Dies geschieht heute in den meisten Fällen, weil die global agierenden Unternehmen ihre Produkte weltweit anbieten und vermarkten möchten. Es gibt allerdings auch noch immer nationale Zulassungen, zum Beispiel für pflanzliche Mittel, wenn solche Mittel nur in Deutschland angeboten werden sollen. Grundsätzlich benötigen alle Arzneimittel, die in Deutschland „im Verkehr“ sind, die also vermarktet werden, eine Zulassung; auch zu erkennen an einer „Zul.-Nr.“, die auf den Packungen aufgedruckt ist. Homöopathische Mittel werden übrigens nur registriert (Reg.-Nr.), wenn sie keinen bestimmten Indikationsanspruch tragen. Teil der Zulassung sind zudem die Information für die Verbraucher (Packungsbeilage oder Beipackzettel) sowie die Fachinformationen für Ärzte und Apotheker.
Nach der Zulassung die Vermarktung …
Wenn die Arzneimittel erst einmal auf dem Markt angeboten und auch bei mehr Menschen als in den klinischen Studien angewendet werden, kann es neue Erkenntnisse zu den jeweiligen Mitteln geben; etwa bis dahin unbekannte unerwünschte Wirkungen (Nebenwirkungen). Wenn die neu erkannten Risiken eine inakzeptable Gefahr für den Patienten darstellen, kann das BfArM auch eine Marktrücknahme verfügen, wie zum Beispiel beim Rheumamittel Vioxx oder beim Cholesterinsenker Lipobay.
Nach der Zulassung beginnen auch die Marketingaktivitäten der pharmazeutischen Hersteller für ihre neu zugelassenen Arzneimittel. Denn sie versprechen sich mit dem Mittel verständlicherweise auch einen ökonomischen Erfolg. Diese Marketingaktivitäten und auch der Preis für ein neues Arzneimittel, das im Rahmen der gesetzlichen Krankenversicherung (GKV) verordnet werden kann, waren bis zum Ende des Jahres 2010 wenig beeinflusst „von außen“. Mit dem Arzneimittelmarktneuordnungsgesetz (AMNOG) gab es dann aber gesetzliche Interventionen, die den Entscheidungsraum der pharmazeutischen Hersteller begrenzten und die eine Prüfung des patientenorientierten Zusatznutzens in den Mittelpunkt stellen.
Zulassungsnutzen ist noch kein Patientennutzen
Wenn wir über den patientenorientierten Nutzen von Arzneimitteln sprechen, dann sind da-mit zumindest die vier Kriterien eingeschlossen, die im § 35b SGB V genannt sind: Es geht um die Verringerung der Sterblichkeit durch die Erkrankung, gegen die das jeweilige Arzneimittel eingesetzt werden soll; um die Verringerung der Belastung durch die jeweilige Krankheit; um die Verringerung der unerwünschten Begleiterscheinungen durch das neue Arzneimittel im Vergleich zu anderen; und um die Verbesserung der Lebensqualität der Patienten. Warum ist das so wichtig? Ein Beispiel: Vor vielen Jahren wurde ein neues Mittel zur Senkung des hohen Blutdrucks zugelassen. Es senkte tatsächlich den zu hohen Blutdruck auf den Normalbereich, ohne besonders auffällige Nebenwirkungen zu verursachen. Dennoch führte das Mittel nicht dazu, dass weniger Menschen starben, weil nach etwa sechs bis sieben Jahren bei bestimmten Patienten unerwartet eine höhere Sterberate zu beobachten war. Die Senkung des zu hohen Blutdrucks hat also nicht dazu geführt, dass die Mortalität verringert wurde.
Dieses Beispiel zeigt, dass die Zulassung zwar eine notwendige Voraussetzung für die Anwendung eines Arzneimittels ist. Aber mit der Zulassung können keineswegs auch der patientenorientierte Nutzen und der Zusatznutzen gegenüber anderen Arzneimitteln oder anderen Behandlungsmethoden ausreichend geprüft werden. Der Begriff „Nutzen“ im AMG ist ein anderer als der, den man als Arzt als Voraussetzung für eine therapeutische Wirksamkeit und für einen Behandlungsnutzen auf Dauer bei der Behandlung von Patienten benötigt, um eine möglichst richtige Entscheidung treffen zu können. Das ist übrigens gemeint, wenn im SGB V die Forderungen in den §§ 2, 12 und 70 aufgestellt werden, dass alle Leistungen, die im Rahmen der GKV zur Anwendung kommen, dem allgemein anerkannten Kenntnisstand in der Medizin zu entsprechen haben, den therapeutischen Fortschritt berücksichtigen müssen und zweckmäßig, wirtschaftlich und human zu erbringen sind.
Daher ist das AMNOG, das vom Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) und vom Gemeinsamen Bundesausschuss (G-BA) seit dem 1. Januar 2011 umgesetzt wird, auch eine Strategie zur patientenorientierten Ergänzung des AMG. Während im AMG das Arzneimittel einzeln geprüft und eine absolute Entscheidung für oder gegen die Zulassung zum Tragen kommt, wird in dem AMNOG-Prozess jedes neue Mittel im Vergleich zu den Mitteln bewertet, die schon bis-her als zweckmäßig in der Therapie gelten. Und es wird geprüft, ob man von dem neuen Mittel einen Zusatznutzen erwarten darf, der den Patientennutzen besser berücksichtigt als die bisher verfügbaren Mittel. Und letztlich wird dieser Zusatznutzen in einen Preis übersetzt, den das jeweilige Arzneimittel im Rahmen der GKV kosten soll.
Mit diesem Verfahren, in dessen Mittelpunkt möglichst immer der Vergleich steht, wird daher die Unterscheidung getroffen, die im Rahmen der Zulassung nicht getroffen werden kann: Können Patienten von dem neuen Mittel einen höheren therapeutischen Nutzen erwarten, wird die Therapie in der jeweiligen Indikation erkennbar verbessert und ist das Mittel daher auch einen höheren Preis wert als die bisher angebotenen Präparate („Money for Value“ und „Value for Money“)? Die zugelassenen Präparate, bei denen dies nicht zu erwarten ist, werden zum Beispiel trotz ihres Patentschutzes in eine Festbetragsgruppe mit relativ niedrigen Preisen eingeordnet. Vor dem Inkrafttreten des AMNOG konnten für diese Produkte wegen der Möglichkeit für die Hersteller, den Preis selbst festzusetzen, erhebliche Umsätze und Profite im Markt erreicht werden.
Diese Mittel, oft auch als Scheininnovationen oder Me-Too-Präparate bezeichnet (Me-Too, weil die Hersteller mit solchen Präparaten auch in einem lukrativen Markt mitverdienen wollten), haben über Jahre den Markt „verstopft“, intransparent gemacht und die Arzneimittelversorgung unnötig verteuert. Die Hochglanzbroschüren haben dazu ebenso beigetragen wie die Attitüde von rund 39 Prozent der niedergelassenen Ärzte, gerne neue Arzneimittel zu verordnen, weil sie damit, in diesem Fall aber unberechtigterweise, einen therapeutischen Fortschritt verbunden sahen.
Das AMNOG als Instrument für einen Qualitätswettbewerb
Das AMNOG macht Schluss mit diesen Strategien. Es klassifiziert nach der Zulassung der Mittel auf der Basis einer umfangreichen Literaturrecherche und einer anderen Bewertungsmethodik die neuen Arzneimittel unter anderen Bedingungen als das AMG: BfArM bzw. EMA einerseits und IQWiG bzw. G-BA andererseits haben unterschiedliche gesetzlich geregelte Aufgabenbereiche; die absoluten Entscheidungen in der Zulassung werden letztlich durch relativ orientierte und vergleichende Bewertungen ergänzt und damit den Anforderungen des SGB V angepasst.
Vor 2011 war ausschließlich die Zulassung die Voraussetzung für die Verordnungsfähigkeit eines Arzneimittels im Rahmen der GKV. Nun ist diese allgemeine Zulassung um ein Bewertungsverfahren ergänzt worden, das bei den künftig zugelassenen Arzneimitteln durchlaufen werden muss: Es gibt nun also einen echten Wettbewerb um Qualität und Nutzen von Arzneimitteln, weil nur bei einer positiven Bewertung der Zugang zum lukrativen Versorgungsmarkt der GKV mit ihren rund 70 Millionen potenziellen „Kunden“ offen steht. Wirkliche Innovationen werden gefördert, unnötige neue Arzneimittel werden vom Markt ferngehalten – das AMNOG ist daher keine Innovationsbremse, wie uns die Pharmaindustrie immer wieder glauben machen will, sondern setzt eine wettbewerbliche Differenzierung um. Und wer immer den Wettbewerb gepredigt hat, muss ihn jetzt auch aushalten – der bisherige Wettbewerb um Deutungshoheit und Entscheidungsmacht hat viel zu lange nur die pharmazeutischen Hersteller begünstigt.







 Gesunde Lebenswelten – Ein Angebot der Ersatzkassen
Gesunde Lebenswelten – Ein Angebot der Ersatzkassen Landesbasisfallwerte 2025
Landesbasisfallwerte 2025 ICF – Internationale Klassifikation der Funktionsfähigkeit, Behinderung und Gesundheit
ICF – Internationale Klassifikation der Funktionsfähigkeit, Behinderung und Gesundheit Beitragsbemessungs- grenzen und Beitragssätze 2024
Beitragsbemessungs- grenzen und Beitragssätze 2024 Heilmittelversorgung – Verträge und Vergütungen
Heilmittelversorgung – Verträge und Vergütungen


